5 Perkembangan Teori Atom Dari Masa Ke Masa, Lengkap Penjelasan dan Gambar
Perkembangan teori atom berawal dari konsep materi Demokritus yang menyatakan bahwa jika suatu materi dibagi menjadi bagian yang lebih kecil, lalu dibagi lagi hingga pada suatu saat diperoleh bagian terkecil yang tidak dapat dibagi lagi yang disebut Atom.
Pengertian Atom adalah suatu satuan dasar materi yang terdiri dari inti atom dan elektron bermuatan negatif yang mengelilinginya. Inti atom terdiri dari proton (bermuatan positif) dan neutron (bermuatan netral), kecuali pada inti atom Hidrogen-1, karena tidak memiliki neutron.
Nah, pada kesempatan kali ini akan kita bahas secara lengkap mengenai 5 Perkembangan Teori Atom dari masa ke masa beserta kelebihan dan kekurangannya. Untuk lebih jelasnya lagi, yuk langsung saja kita simak pembahasannya dibawah ini.
Pengertian Atom adalah suatu satuan dasar materi yang terdiri dari inti atom dan elektron bermuatan negatif yang mengelilinginya. Inti atom terdiri dari proton (bermuatan positif) dan neutron (bermuatan netral), kecuali pada inti atom Hidrogen-1, karena tidak memiliki neutron.
Nah, pada kesempatan kali ini akan kita bahas secara lengkap mengenai 5 Perkembangan Teori Atom dari masa ke masa beserta kelebihan dan kekurangannya. Untuk lebih jelasnya lagi, yuk langsung saja kita simak pembahasannya dibawah ini.
1. Teori Atom Dalton
 |
| Model Atom Dalton |
Teori Atom Dalton merupakan sebuah teori tentang atom yang ditemukan oleh John Dalton pada tahun 1803. Menurut John Dalton, teori atom didasarkan pada hukum lavoisier (hukum kekekalan massa) dan hukum prouts (hukum susunan tetap).
Hukum Lavosier menyatakan bahwa “Massa total zat-zat sebelum reaksi akan selalu sama dengan massa total zat-zat hasil reaksi”. Hukum Prouts menyatakan bahwa “Perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap”. Dari kedua hukum tersebut diperoleh pokok-pokok teori atom Dalton, diantaranya yaitu:
- Atom merupakan partikel terkecil yang tidak bisa dibagi lagi.
- Atom berbentuk bola sederhana dan berukuran sangat kecil.
- Gabungan beberapa atom akan membentuk suatu senyawa dengan perbandingan bilangan bulat dan sederhana.
- Atom tidak dapat diciptakan atau dimusnahkan karena adanya reaksi kimia yang merupakan pemisahan, penggabungan, atau penyusunan kembali atom-atom.
- Suatu unsur tersusun dari atom-atom yang sama.
- Suatu senyawa tersusun dari atom-atom yang berbeda sesuai unsur penyusunnya.
Adapun kelebihan dan kelemahan dari teori atom Dalton yaitu sebagai berikut:
Kelebihan
Kelebihan
- Meningkatkan rasa minat terhadap penelitian model atom berikutnya.
Kelemahan
- Tidak dapat menjelaskan tentang bagaimana cara atom-atom saling berikatan.
- Tidak dapat menjelaskan hubungan antara larutan senyawa dengan daya hantar arus listrik, karena atom merupakan bagian terkecil dari suatu unsur yang tidak bisa dibagi lagi.
- Tidak dapat menjelaskan sifat listrik materi.
- Tidak dapat menjelaskan perbedaan antara atom unsur yang satu dengan atom unsur yang lain.
2. Teori Atom Thomson
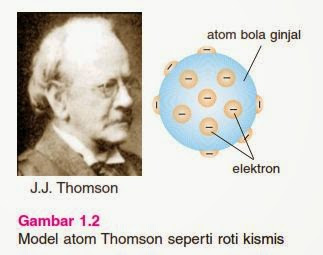 |
| Model Atom Thomson |
Teori Atom Thomson muncul setelah teori atom Dalton pada tahun 1803. Teori ini merupakan penyempurnaan dari teori atom Dalton. J.J. Thomson memperbaiki kelemahan dari teori atom Dalton dengan penemuannya yaitu elektron pada tahun 1897. Elektron adalah partikel yang bermuatan negatif.
Penemuan elektron oleh J.J. Thomson diperoleh melalui percobaan tabung sinar katode. Berdasarkan percobaan tabung sinar katode, J.J. Thomson menyimpulkan bahwa sinar katode merupakan sebuah partikel, karena dapat memutar baling-baling yang diletakkan diantara anode dan katode. Partikel tersebut merupakan partikel penyususn atom yang bermuatan negatif yang kemudian disebut dengan elektron.
Isi dari teori atom Thomson yaitu atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar elektron yang bermuatan negatif. Teori ini disebut juga sebagai teori roti kismis. Mengapa demikian? Karena roti digambarkan sebagai atom yang bermuatan positif dengan melekatnya kismis disekeliling roti yang digambarkan sebagai elektron yang bermuatan negatif.
Adapun kelebihan dan kelemahan dari teori atom Thomson yaitu sebagai berikut:
Kelebihan
- Membuktikan bahwa atom bukan merupakan bagian terkecil dari suatu unsur. Hal itu karena Thomson menemukan adanya partikel lain yang bermuatan negatif dalam atom.
- Membuktikan bahwa atom bersifat netral yang tersusun dari partikel-partikel yang bermuatan positif dan negatif.
- Membuktikan bahwa adanya elektron dalam semua unsur.
Kekurangan
- Tidak dapat menjelaskan tentang susunan muatan positif dan jumlah elektron dalam bola.
- Tidak dapat menjelaskan tentang inti atom.
3. Teori Atom Rutherford
 |
| Model Atom Rutherford |
Teori Atom Rutherford didasarkan pada suatu eksperimen yaitu penembakan partikel alfa terhadap lempeng emas. Eksperimen tersebut dikenal dengan eksperimen 'Geiger-Marsden'. Pada saat itu, Rutherford bersama dua orang muridnya yaitu Hans Geiger dan Erners Masreden melakukan suatu percobaan penembakan partikel/sinar alfa terhadap lempeng tipis emas. Partikel alfa merupakan partikel yang bermuatan positif, bergerak lurus, serta memiliki daya tembus yang besar.
Pada percobaan tersebut sinar alfa yang ditembakkan pada lempeng emas ada yang dibelokkan, dipantulkan dan diteruskan. Tujuan sebenarnya dilakukan percobaan tersebut yaitu untuk membuktikan kebenaran teori atom Thomson, yaitu apakah benar atom merupakan bola pejal yang bermuatan positif yang jika dikenai partikel alfa akan dipantulkan atau dibelokkan.
Hasil yang diperoleh dari percobaan tersebut kemudian dikembangkan ke dalam hipotesis teori atom Rutherford, diantaranya yaitu :
- Elektron yang bermuatan negatif bergerak mengelilingi inti atom yang bermuatan positif dengan kecepatan yang sangat tinggi.
- Atom mempunyai inti atom (bermuatan positif) yang menjadi pusat massa atom.
- Penyebaran partikel alfa tidak dipengauhi oleh awan elektron.
- Sebagian besar dari atom merupakan permukaan yang hampa atau kosong.
- Sebagian kecil partikel alfa yang lewat akan dibelokkan dan sedikit sekali dipantulkan. Sebagian besar lainnya tidak mengalami pembelokkan/hambatan.
Pada tahun 1911, berdasarkan eksperimen Geiger-Marsden, Rutherford menyangkal kebenaran teori atom Thomson yang menyatakan bahwa atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar elektron yang bermuatan negatif. Rutherford menyatakan bahwa atom memiliki inti yang merupakan pusat massa yang dinamakan nukleus yang dikelilingi oleh awan elektron yang bermuatan negatif. Pernyartaan tersebut kemudian dikenal dengan teori atom Rutherford.
Adapun kelebihan dan kelemahan dari teori atom Dalton yaitu sebagai berikut:
Kelebihan
- Dapat menggambarkan dan menjelaskan bentuk lintasan elektron yang mengelilingi inti atom, sehingga mudah dipahami.
- Dapat menyimpulkan bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti atom yang dimana satu sama lain terpisah oleh ruang hampa.
- Dapat menjelaskan pergerakan elektron disekitar inti atom
Kekurangan
- Tidak mampu menjelaskan mengapa elektron tidak pernah jatuh ke dalam inti atom sesuai dengan teori fisika klasik.
- Tidak mampu menjelaskan tentang spektrum garis pada atom hidrogen (H).
- Tidak mampu menjelaskan letak elektron dan cara rotasinya terhadap inti atom.
- Elektron yang bergerak akan memancarkan energi, sehingga energi atom menjadi tidak stabil.
4. Teori Atom Bohr
 |
| Model Atom Neils Bohr |
 |
| Model Atom Neils Bohr |
Pada tahun 1913, seorang pakar fisika dari Denmark yang bernaman Neils Bohr melakukan eksperimen yaitu spektrum atom hidrogen. Eksperimen tersebut bertujuan untuk menyempurnakan teori atom Rutherford. Eksperimennya ini berhasil menggambarkan keadaan elektron dalam menempati daerah disekitar inti atom.
Penjelasan Bohr mengenai atom hidrogen merupakan gabungan antara teori klasik dari Rutherford dengan teori kuantum dari Planck. Berikut hipotesa (postulat) dari teori atom Bohr, diantaranya yaitu:
- Elektron dapat berpindah dari orbit satu ke orbit yang lain berdasarkan tingkatan energi. Elektron akan berpindah ke orbit yang memiliki energi lebih tinggi jika elektron menyerap energi yang besarnya sama dengan perbedaan energi antara kedua orbit yang bersangkutan. Sebaliknya, elektron yang berpindah ke orbit yang memiliki energi lebih rendah akan memancarkan energi radiasi yang teramati sebagai spektrum garis yang besarnya sama dengan perbedaan energi antara kedua orbit yang bersangkutan.
- Selama dalam orbitnya, elektron dalam keadaan stationer dan tidak memancarkan energi.
- Jika elektron-elektron berpindah dan menempati orbit yang lebih tinggi, maka atom dalam molekul berada dalam tingkat tereksitasi (excited state). Jika elektron-elektron berpindah dan menempati orbit yang lebih rendah, maka atom dalam molekul berada dalam tingkat dasar (ground state).
- Elektron mengelilingi inti atom dalam orbit-orbit tertentu yang berbentuk lingkaran yang sering disebut sebagai kulit-kulit elektron. Kulit-kulit elektron dinyatakan dalam bentuk notasi K, L, M, N, ... dan seterusnya.
- Energi yang dimiliki elektron pada masing-masing orbit dapat mempengaruhi besar kecilnya lingkaran orbit. Semakin tinggi energi elektron dalam orbit maka semakin besar pula lingkaran orbitnya dan sebaliknya.
Teori atom Bohr dapat digambarkan seperti sebuah tata surya mini (seperti gambar diatas), dimana elektron-elektron yang berada di lintasan beredar mengelilingi inti atom yang bermuatan positif dan berukuran sangat kecil. Namun bedanya, pada sistem tata surya setiap planet hanya menempati 1 lintasan (orbit) saja, sedangkan pada atom setiap elekron bahkan lebih dapat menempati 1 lintasan (kulit atom).
Berdasarkan teori atom Bohr, elektron-elektron yang mengelilingi inti atom pada lintasan-lintasan tertentu yang disebut kulit elektron atau tingkat energi. Tingkat energi paling tinggi adalah kulit elektron yang terletak paling luar serta penomoran kulitnya paling besar, semakin dalam letak kulit elektron maka semakin kecil nomor kulitnya dan semakin rendah tingkat energinya.
Dalam model atom Bohr terdapat susunan elektron pada masing-masing kulit atom yang disebut konfigurasi elektron. Nomor atom suatu unsur merupakan data yang digunakan untuk menuliskan konfigurasi elektron. Nomor atom suatu unsur menyatakan jumlah elektron dalam atom unsur tersebut. Sedangkan elektron pada kulit terluar disebut sebagai elektron valensi. Susunan elektron valensi berperan penting dalam membentuk suatu ikatan dengan atom lain serta menentukan sifat-sifat kimia suatu atom.
Adapun kelebihan dan kelemahan dari teori atom Bohr yaitu sebagai berikut:
Kelebihan
- Dapat memperbaiki kelemahan dari teori atom Rutherford.
- Dapat membuktikan adanya lintasan elektron untuk atom hidrogen.
- Dapat menjelaskan spektrum atom hidrogen secara akurat.
Kekurangan
- Tidak dapat menjelaskan spektrum warna dari atom-atom yang mempunyai banyak elektron atau yang lebih kompleks.
- Tidak dapat menjelaskan adanya garis-garis halus dalam spektrum hidrogen (efek Zeeman) karena Bohr mengganggap elektron sebagai partikel.
- Model atom Bohr memiliki nilai momentum sudut lintasan ground state yang salah.
- Tidak bisa mengetahui intensitas relatif garis spektra.
- Tidak bisa menjelaskan struktur garis spektra yang baik.
- Tidak dapat menjelaskan atom selain atom hidrogen.
5. Teori Atom Modern
 |
| Model Atom Modern |
Teori atom modern berkembang setelah teori atom Bohr. Pada tahun 1924, seorang ahli fisika prancis yang bernama Louis de Broglie menyempurnakan kelemahan dari teori atom Bohr yang tidak mampu menerangkan model atom selain atom hidrogen serta gejala atom dalam medan magnet. Menurut Broglie, elektron tidak hanya bersifat partikel, elektron juga bisa bersifat gelombang. Sedangkan menurut Neils Bohr, elektron adalah partikel.
Pendapan Louis de Broglie kemudian dikembangkan lagi oleh Edwin Schrodinger dan Werner Heisenberg dan melahirkan teori atom modern. Teori atom modern disebut juga sebagai teori mekanika kuantum. Prinsip dasar teori atom modern adalah gerakan elektron dalam mengelilingi inti bersifat seperti gelombang.
Teori ini digunakan untuk menjelaskan sifat atom dan molekul. Berdasarkan teori mekanika kuantum, kedudukan dan momentum suatu benda tidak mungkin dapat ditentukan secara seksama pada saat bersamaan, yang dapat diketahui hanya kebolehjadian menemukan elektron pada jarak tertentu dari inti atom. Teori tersebut dinamakan prinsip ketidakpastian Heinsenberg yang dikemukakan oleh Werner Heinsenberg, seorang ahli fisika dari Jerman.
Menurut Heisenberg, posisi dan kecepatan elektron yang sedang bergerak secara bersama-sama tidak bisa diukur secara tepat, karena elektron yang bergerak menimbulkan perubahan dalam posisi dan momentum setiap saat.
Prinsip ketidakpastian Heisenberg dan persamaan gelombang oleh Louis de Broglie kemudian dijadikan acuan oleh Erwin Schrodinger untuk merumuskan persamaan Schrodinger, yaitu sebagai berikut:
Sekian artikel tentang 5 Perkembangan Teori Atom Dari Masa Ke Masa, Lengkap Penjelasan dan Gambar. Semoga artikel ini bisa memberikan manfaat bagi sobat baik untuk mengerjakan tugas atau sekedar untuk meningkatkan wawasan tentang perkembangan teori atom serta kelebihan dan kekurangannya, teori atom Dalton, teori atom Thomson, teori atom Rutherford, teori atom Bohr, teori atom modern. Terimakasih buat kunjungannya.
5 Perkembangan Teori Atom Dari Masa Ke Masa, Lengkap Penjelasan dan Gambar
MARKIJAR : MARi KIta belaJAR


Posting Komentar untuk "5 Perkembangan Teori Atom Dari Masa Ke Masa, Lengkap Penjelasan dan Gambar"